咨询热线电话:
0731-85238098 13755178098


【滴定】定义和原理
滴定法是古老的分析方法之一,在多行业都有应用。例如,可用于分析饮用水,也可确定电池材料中的金属含量。
什么是滴定?
滴定法用于测定样品溶液中待分析物的浓度。在样品中加入已知浓度的标准溶液(滴定剂),滴定剂和被分析物发生化学反应,通过滴定剂的消耗体积、浓度和样品的量来计算待分析物浓度。滴定中的常用术语(按字母顺序排列)及其定义见下表。

如何进行滴定?
1.滴定剂标定
滴定剂需要先进行标定,才能获得滴定剂的准确浓度,也提高了结果的准确性。
2.样品制备
如果进行滴定,样品应该是溶液。因此,如果是固体样品,需要先溶解或预处理来释放出被分析物质(例如,通过消解、萃取或灰化过程)。有时还需要添加辅助溶液。例如,氧化还原滴定通常需要在特定的 pH 值下进行。间接滴定需要辅助溶液,因为某些分析物不能直接与滴定剂反应,可预先通过其它反应使其转变成能与滴定剂定量反应的产物,间接测定其含量。对于返滴定来说,要先加入过量的试剂。这种试剂会与被分析物发生反应,然后对过量的试剂进行滴定。
3.滴定
在滴定过程中,样品溶液的搅拌非常重要。这样可以确保滴定剂和被分析物充分混合。滴定剂加入样品,使其余样品充分反应,到达滴定终点。手动滴定使用颜色指示剂来确定终点。自动电位滴定仪使用电极来检测等当点。将滴定剂的体积与测量到的信号进行对比,即可得到滴定曲线。图1 显示了含有碳酸盐杂质的酸碱滴定曲线。
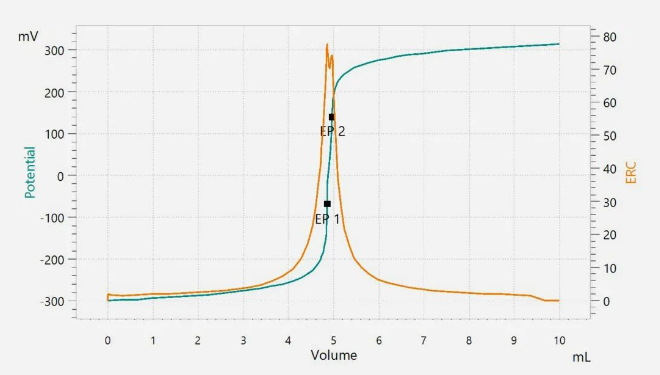
图1. 用盐酸滴定氢氧化锂的滴定曲线。第一个等当点(EP1)对应氢氧化物,第二个等当点(EP2)对应碳酸盐杂质。
4.结果计算
滴定结束后,要计算滴定结果。自动电位滴定仪会自动进行计算。

根据结果的单位,计算公式会有所不同。